Оплата и способы получения
Аналоги Копаксон 40
Инструкция на Копаксон 40 40 мг/мл, раствор для подкожного введения, 1 мл, 12 шт.
Состав
Описание
Слегка опалесцирующий раствор от бесцветного до светло-желтого цвета.
Фармакодинамика
Фармакокинетика
Копаксон 40: Показания
Рецидивирующе-ремиттирующий рассеянный склероз.
Способ применения и дозы
П/к, по 40 мг препарата Копаксон® 40 (один заполненный раствором препарата шприц для инъекций) 3 раза в неделю, минимальный интервал между инъекциями — 48 ч. Препарат не предназначен для в/в или в/м введения.
В настоящее время данные о длительности курса лечения отсутствуют. Решение о назначении длительного курса лечения должен принимать лечащий врач в каждом конкретном случае.
Пациентам рекомендуется пройти обучение по технике самостоятельного проведения инъекций. Первая инъекция (а также 30 мин после нее) должна проходить под наблюдением квалифицированного специалиста. Для снижения риска появления раздражения или боли в области инъекции каждый раз необходимо менять зону для введения инъекции.
Каждый шприц с препаратом Копаксон® 40 предназначен только для однократного применения.
Рекомендации для пациентов по применению препарата
1. Убедиться в том, что у пациента есть все необходимое для инъекции: одноразовый шприц, заполненный раствором препарата Копаксон® 40, контейнер для использованных шприцев, ватный тампон, смоченный спиртом.
2. Перед инъекцией извлечь одноразовый шприц из контурной ячейковой упаковки, удалив защитную бумажную полоску.
3. Выдержать шприц с раствором при комнатной температуре не менее 20 мин.
4. Перед введением препарата Копаксон® 40 тщательно вымыть руки с мылом.
5. Внимательно осмотреть раствор в шприце. При наличии взвешенных частиц или изменений цвета раствора его не следует применять.
6. Выбрать место для инъекции.
Возможные зоны для самостоятельных инъекций обозначены на рис. 1: руки, бедра, ягодицы, живот (примерно 5 см вокруг пупка). Не следует проводить инъекцию в болезненные места, обесцвеченные, покрасневшие участки кожи или области с уплотнениями и узелками. Внутри каждой инъекционной зоны достаточно места для нескольких инъекций. Рекомендуется составить схему мест инъекций и иметь ее при себе. Для инъекций на ягодицах и руках пациенту может потребоваться помощь другого человека.
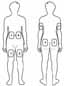
Рисунок 1. Схема расположения мест инъекций
7. Снять защитный колпачок с иглы.
8. Предварительно обработав место инъекции ватной салфеткой, смоченной спиртовым раствором, слегка собрать кожу в складку большим и указательным пальцами (рис.2).
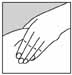
Рисунок 2.
9. Располагая иглу шприца перпендикулярно месту инъекции (рис. 3), проколоть кожу и равномерно надавливая на поршень шприца, ввести его содержимое в место инъекции.
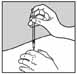
Рисунок 3.
10. Удалить иглу движением шприца перпендикулярно месту инъекции.
11. Поместить шприц в контейнер для использованных шприцев.
Если пациент забыл ввести препарат Копаксон® 40, следует сделать инъекцию немедленно, как только пациент вспомнил об этом. Нельзя вводить двойную дозу препарата.
Особые группы пациентов
Дети. Препарат не рекомендован к применению у пациентов до 18 лет, поскольку клинические исследования у этих возрастных групп не проводились.
Пожилой возраст. Эффективность и безопасность препарата у пожилых людей не изучались.
Нарушение функции почек. Эффективность и безопасность препарата у пациентов с почечной недостаточностью не изучались.
Применение при беременности и кормлении грудью
Данных о применении препарата Копаксон® 40 во время беременности нет, возможный риск применения во время беременности не установлен.
Проведенные исследования на животных недостаточны для установления влияния препарата на беременность, развитие эмбриона/плода, роды и постнатальное развитие. Препарат Копаксон® 40 противопоказан во время беременности. Во время лечения необходимо использовать надежные методы контрацепции.
Неизвестно, выделяется ли глатирамера ацетат с грудным молоком, поэтому при необходимости применения препарата Копаксон® 40 в период лактации следует оценить ожидаемую пользу терапии для матери и потенциальный риск для ребенка.
Копаксон 40: Противопоказания
Копаксон 40: Побочные действия
Передозировка
Взаимодействие
Взаимодействие между препаратом Копаксон® 40 и другими лекарственными препаратами отдельно не оценивалось. Нет данных о взаимодействии с интерфероном бета.
Выявлено увеличение случаев реакций в месте инъекций при одновременном введении препарата Копаксон® 40 с ГКС.
В исследовании in vitro было сделано предположение, что глатирамера ацетат имеет высокий уровень связи с белками плазмы крови и не вытесняется из связи с белками плазмы крови самостоятельно, а также фенитоином или карбамазепином. Тем не менее, поскольку препарат Копаксон® 40 обладает потенциальным воздействием на протеинсвязывающие вещества, необходимо контролировать его одновременное применение с другими лекарственными препаратами.
Особые указания
Форма выпуска
Срок годности
Условия отпуска
По рецепту.
Производитель
Характеристики
Сертификаты Копаксон 40 40 мг/мл, раствор для подкожного введения, 1 мл, 12 шт.


Цены в аптеках на Копаксон 40 40 мг/мл, раствор для подкожного введения, 1 мл, 12 шт.



История стоимости Копаксон 40 40 мг/мл, раствор для подкожного введения, 1 мл, 12 шт.
Цены Копаксон 40 и наличие в аптеках в Воронеже
Отзывы о Копаксон 40
Дистанционная торговля лекарственными препаратами осуществляется исключительно аптечными организациями, имеющими действующую лицензию на фармацевтическую деятельность, а также разрешение на дистанционную торговлю лекарственными препаратами. Дистанционная торговля рецептурными лекарственными препаратами, наркотическими и психотропными, а также спиртосодержащими лекарственными препаратами запрещена действующим законодательством РФ и не осуществляется.
На информационном ресурсе применяются рекомендательные технологии .